

在现代生物医药领域,纳米抗体(也叫VHH抗体)正逐渐成为一种备受关注的研究工具和药物开发新宠。它们源自骆驼科动物,也被称为Camelid抗体,结构简单却异常灵活。相比传统抗体,纳米抗体分子小、稳定性强、易于表达和改造。无论是基础科研还是药物研发,纳米抗体的定制需求正在迅速攀升。
那么,纳米抗体定制背后究竟包含哪些关键技术?从筛选到表达,再到纯化和亲和力优化,每一步都紧密影响最终产品的质量和效果。今天,我们来聊聊这套技术流程,以及它在科研和药物开发中的实际应用。
纳米抗体,严格来说,是一种重链抗体(Heavy-chain antibody),只由单个可变结构域组成。它们不依赖轻链,属于单域抗体(single-domain antibody)。这使得它们比传统抗体更小巧,约只有普通IgG抗体的十分之一大小。
在纳米抗体的开发中,抗体的天然来源对亲和力、多样性及表达稳定性至关重要。除了早期研究中常用的Dromedary camel(Camelus dromedarius)外,Llama(Lama glama)和Alpaca(Lama pacos)逐渐成为构建高质量VHH抗体库的首选物种。这些动物均属于Camelid科,能够自然产生仅由重链组成的抗体(Heavy-chain-only antibodies),其可变区即为我们熟知的VHH抗体或纳米抗体。
相较于传统IgG抗体,来自Llama和Alpaca的单域抗体具备更强的稳定性与组织穿透能力,尤其适合用于酶活性位点、跨膜蛋白等结构复杂的靶点筛选。基于这些Camelid物种构建的纳米抗体库,可通过噬菌体展示筛选技术进行高通量筛选,快速获得高亲和力的候选分子,为科研级抗体定制与纳米抗体药物开发奠定基础。
在实际项目中,不同Camelid物种来源的抗体模板各有优势,例如:
Dromedary camel来源的VHH结构更保守,适合结构建模;
Llama来源抗体在抗原结合多样性上表现优异;
Alpaca抗体表达效率高,尤其适合大规模生产与工程改造。
因此,在进行Camelid抗体开发或重链抗体定制时,合理选择动物来源,将直接影响后续的亲和力优化、人源化处理和下游表达效率。
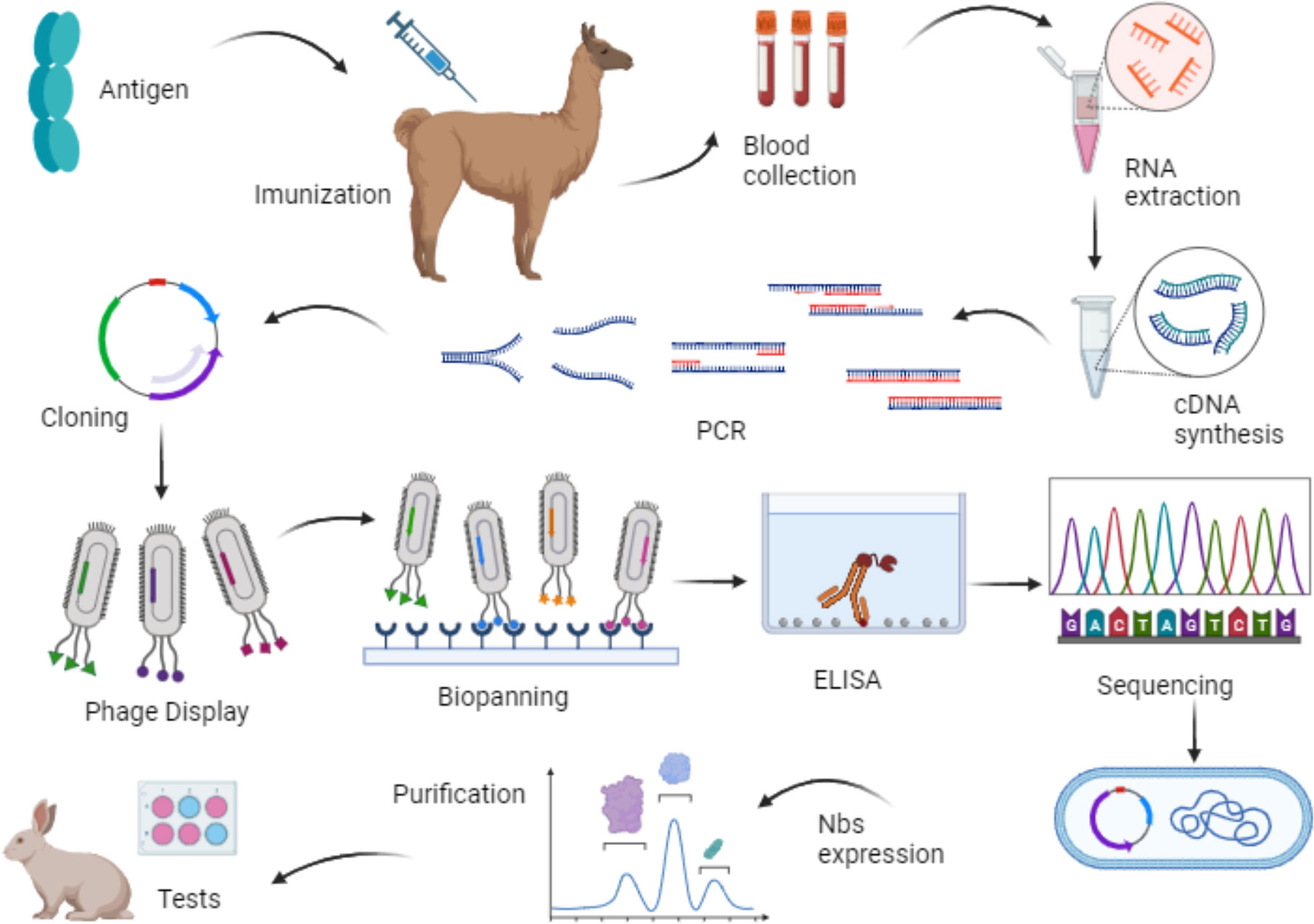
如何找到适合的纳米抗体?答案是噬菌体展示筛选。这种技术可以理解为“用噬菌体做钓鱼”,将纳米抗体基因插入噬菌体表面,通过不断“钓”目标抗原,从庞大的抗体库中挑出最合适的“鱼”。
整个筛选过程往往需要多轮,每一轮都严格挑选亲和力更强、特异性更好的候选者。这里面不仅考验技术人员的耐心,也考验实验设计的合理性。
更棒的是,结合抗体结构建模技术,可以预测并优化抗体的结合界面,帮助我们在筛选环节后进一步提升抗体的亲和力和稳定性。
一旦初步筛选得到纳米抗体,接下来的步骤是抗体亲和力优化。通过引入点突变或重组技术,使抗体和靶点结合得更紧密、更专一,这对于提升后续应用的效果至关重要。
在药物开发的背景下,抗体的人源化服务同样重要。因为大多数纳米抗体来自骆驼科动物,未经人源化的抗体在人体内可能引起免疫反应。人源化过程就是将这些外来抗体“改头换面”,使其更接近人体自身的蛋白结构,从而减少免疫排斥,提高安全性。
表达系统的选择直接影响纳米抗体的产量和质量。常用的系统有大肠杆菌表达和哺乳动物细胞表达(例如CHO细胞和HEK293细胞)。
大肠杆菌系统因其成本低、速度快,常被用于早期的纳米抗体制备和筛选阶段。虽然其蛋白质修饰能力有限,但适合大量生产。
相比之下,CHO和HEK293等哺乳动物细胞系统能够进行更复杂的蛋白修饰,生产出更接近天然状态的抗体产品,满足更高的应用标准。
纯化过程通常采用亲和层析技术,结合多步纯化策略,确保产物的纯度和生物活性,为后续研究和药物开发奠定基础。
由于纳米抗体的独特优势,它们已经被广泛应用于多种领域。科研人员利用其特异性强、稳定性好、穿透力强的特点,开发各种精准检测工具和功能验证实验。
在药物开发领域,纳米抗体药物开发正成为热点。小分子量的纳米抗体更容易进入肿瘤微环境,或与细胞内靶点结合,具备优异的治疗潜力。结合抗体工程技术,还可以设计多功能的融合蛋白,实现更复杂的治疗效果。
纳米抗体技术的每一步,其实都反映了抗体研发从“结构”走向“功能”的进化过程。它不是某一种产品的堆叠,而是一种深度整合的开发逻辑。从筛选技术的严谨性、表达系统的适配性,到优化策略的科学性,每个节点都影响着抗体能否在真实应用场景中发挥效力。
Q1:纳米抗体筛选过程中,如何判断筛选出的抗体具有高靶点特异性?
A: 靶点特异性主要通过多轮噬菌体展示筛选结合ELISA、BLI等手段进行评估。在构建VHH抗体库并筛选后,通过对抗体与靶蛋白的结合亲和力、交叉反应性及非特异性结合数据进行系统分析,可确认是否获得具备高靶向性的单域抗体。
Q2:Camelid抗体开发通常优选Llama还是Alpaca?为什么?
A: 两者都属于驼科(Camelidae)动物,均能产生稳定的VHH抗体。Llama抗体开发常用于多样性丰富的文库构建,Alpaca则更适合表达和亲和力优化,在工业级表达系统(如E. coli 或 HEK293)中具有更好的兼容性。具体选择需根据靶点特性和项目预算灵活配置。
Q3:科研级抗体定制与药物级抗体开发的流程差别在哪?
A: 科研级通常以速度和筛选为主,流程聚焦在纳米抗体筛选、功能验证和初步表达。而药物级开发则涉及更严格的流程控制、抗体亲和力优化、成药性评估、抗体结构建模,并需在CHO等系统中开展规模化的抗体表达纯化服务。
Q4:结构建模在纳米抗体开发中扮演什么角色?
A: 在VHH抗体筛选完成后,抗体结构建模可用于预测抗原结合位点(CDR区)、优化亲和力、提高稳定性和改良构象。通过AI驱动的建模技术与分子对接分析,研发团队可提前判断抗体的潜在活性,提升筛选效率,降低实验成本。
Q5:纳米抗体在精准医疗或诊断平台中的典型应用有哪些?
A: 凭借其高稳定性和小尺寸,纳米抗体被广泛应用于肿瘤成像、病毒检测、生物传感器等领域。例如,将VHH抗体偶联荧光探针用于实时追踪肿瘤细胞;或将其固定在生物芯片上用于快速诊断。通过高通量科研级抗体定制,可快速开发靶点特异性纳米抗体,支持不同检测平台。