

重组蛋白(包括细胞因子、酶、抗体、融合蛋白、膜蛋白等)在基础研究与生物医药产业中具有重要应用。为了得到具有正确折叠结构、适当翻译后修饰(如糖基化、磷酸化、二硫键形成等)和生物活性的蛋白,选择合适的表达系统至关重要。相比细菌、酵母、昆虫细胞等表达系统,哺乳动物细胞表达系统能够最大限度地模拟天然的哺乳动物细胞环境,对许多复杂蛋白(尤其是需糖基化或膜结合的蛋白)而言,是更优选方案。
一、哺乳动物细胞表达系统的特点与优势
1. 正确的翻译后修饰能力
哺乳动物细胞具备对蛋白进行糖基化、剪切、磷酸化、羟基化、甲基化、硫酸化、脂基化、二硫键形成与正确折叠装配等多种修饰能力。相比之下,细菌不具备糖基化能力,酵母会产生高甘露糖型糖基化结构,可能被宿主清除或引起免疫原性问题。
2. 蛋白功能更接近天然
通过哺乳动物细胞表达得到的蛋白更有可能获得正确的构象、辅助亚基结合及配体结合能力,因此在体外和体内功能测试、结构解析、药物筛选中更具可靠性。
3. 分泌表达与可溶性表达
哺乳动物细胞能够分泌大量重组蛋白,简化下游纯化流程,并可减少胞内处理过程中的折叠或降解问题。
4. 适合临床应用
对于用于治疗或诊断的蛋白药物,哺乳动物表达系统更能获得符合人体兼容性的糖型和结构,有助于降低免疫原性。
5. 可实现大规模生产
虽然起始产量低于微生物系统,但通过稳定细胞系、优化培养条件与基因工程改造,现代工业化哺乳动物细胞表达已能实现克/升级水平甚至更高产率。已有文献报道一些哺乳动物细胞系统重组蛋白产率可达 3-5 g/L,少部分甚至达 10 g/L 级别。
二、哺乳动物细胞表达系统的分类与选择
表达方式分类
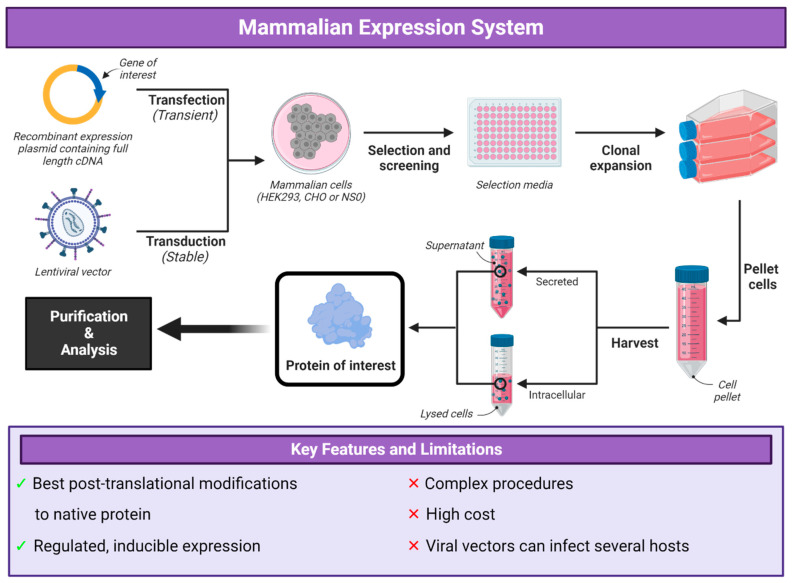
1. 瞬时转染表达(Transient Expression)
通过将重组表达质粒直接导入哺乳动物细胞,短期表达目标蛋白,通常在转染后 2–7 天内完成表达收获。其优点是速度快、操作简单、无需筛选克隆,适合小规模或初步验证。
2. 稳定转染表达(Stable Expression)
将外源基因整合进宿主细胞基因组或以稳定膜粒方式存在,通过筛选抗性标记和克隆培养,获取稳定高表达细胞系。优点是可长期表达、批次一致性强,适合大规模生产。
3. 倍增选择表达 / 基因扩增系统
为提高产量,通常在稳定表达中使用如 DHFR/MTX(甲氨蝶呤)系统、GS(谷氨酰胺合酶)系统等,通过逐步加压(如 MTX 浓度逐步增加)筛选高拷贝细胞株。
4. 外源质粒长期维持型 / 异源复制方式(Episomal / Episomal-based systems)
如 QMCF(QMCF 技术)即为一种结合病毒起始子和细胞内膜粒复制、保留的表达系统,允许质粒在细胞中稳定存在若干代,同时不必整合入基因组,从而在中长期表达中兼具稳定和高产率。
5. 病毒载体介导表达(Virus-based Expression)
利用腺病毒、慢病毒、腺相关病毒(AAV)、逆转录病毒、腺病毒辅助载体(bacMam)等,将基因导入哺乳动物细胞。病毒载体具有转染效率高、可感染非分裂细胞、在某些情况下可实现高表达的优点。但需要考虑病毒安全性、包装限制、生产复杂性、插入效应等问题。
细胞系选择分类
1. HEK293(人胚肾细胞系)
转染效率高、生长速度快、适合悬浮培养改造。目前常用于瞬时表达或中等规模表达。
2. CHO(中国仓鼠卵巢细胞系)
工业生产中最常用的细胞系之一,适合悬浮培养、工业化规模化生产、与人类兼容的糖型修饰能力较好。
3. NS0 细胞
来自动物骨髓瘤,多用于抗体表达体系(例如 GS-NS0 系统)
4. 其他细胞系
如 COS-7、BHK、CHO-S、CHO-K1、Per.C6、HEK293E/HEK293F 以及人工改造系(如表达 EBNA-1 或大 T 抗原以维持质粒的细胞)等。
三、哺乳动物细胞表达的实现流程
1. 目标基因设计与克隆
基因优化:为提高表达效率,通常需要对目标基因做密码子优化,使其更适合宿主细胞的密码子偏好性;删除潜在的不良序列(如内含剪切位点、mRNA 二级结构强干扰区、内含抑制子序列等)。最近有研究通过在基因上游添加 Kozak 序列或 Leader 序列来改善启动子识别与表达效率,在 CHO 细胞中对瞬时与稳定表达均有提升。
构建表达载体:载体基本元件包括启动子(如 CMV、SV40、EF-1α、CAG 等)、增强子、5′ UTR 和 3′ UTR、信号肽(如需分泌表达时)、多克隆位点(MCS)、选择标记(如抗生素抗性、荧光团、筛选标志)、复制子(大肠杆菌复制子)等。
若采用基因扩增策略(如 DHFR/MTX 或 GS 系统),需在载体中加入相应的选择标记或扩增模块。
2. 转染 / 感染导入
化学法转染(如脂质体、聚乙二醇、钙磷酸盐法等):常用于 HEK293 等贴壁或悬浮细胞。
电转法(电穿孔):对于悬浮细胞如 CHO 等较为常用,效率高但对细胞毒性需控制。
病毒介导导入:利用腺病毒、慢病毒、AAV 等高效率将基因导入细胞。适合难转染细胞、贴壁非分裂细胞。
质粒维持 / 异源复制支持型系统:如 QMCF 系统,通过细胞内特定蛋白(如 EBNA-1、Large T)结合质粒上的起始子,使质粒在细胞中保持自我复制,从而长期表达。
3. 筛选与克隆(适用于稳定表达)
筛选:转染后细胞在含有选择剂(如抗生素、抗代谢药物等)培养,以筛去未转染或低表达细胞。若使用扩增系统(如 DHFR/MTX 或 GS),可通过逐步加压(提高 MTX 浓度)扩增目标基因拷贝。
克隆筛选:从筛选池中分离单克隆(例如通过稀释、限度稀释或单细胞排序方法),并评估每克隆的表达水平、稳定性、细胞增殖性等参数,挑选高表达且稳定性好的克隆。
克隆验证:对所选克隆进行长期传代稳定性实验、表达水平检测、基因拷贝数测定、蛋白质质量分析(如正确折叠、糖型结构分析、活性验证等)。
4. 细胞培养与表达阶段
培养条件优化:使用无血清/化学定义培养基、控制细胞密度、优化营养盐浓度、pH、溶氧、温度(有时可采用“温度下降”策略以减缓细胞代谢、提高表达稳定性)等。
生产阶段切换:在稳定表达系统中,通常会将细胞从增殖培养切换到生产培养阶段,可能控制营养供给、限制增殖、启动表达控制(如启动子诱导)等。
规模化培养:对于工业化生产需采用生物反应器(摇瓶→小型反应器→大规模反应器),需考虑混合、气体传递、剪切力、氧气供给、营养梯度等因素。
5. 蛋白收获与纯化
上清收获 / 细胞裂解:若蛋白被分泌至培养上清,可直接收获上清;若为胞内表达蛋白,则需细胞裂解、离心分离等步骤。
下游纯化:常用方法包括亲和层析(如 His-tag、抗体亲和层析)、离子交换层析、凝胶过滤、疏水作用层析等。需要兼顾纯度、回收率及蛋白活性。
质量分析与表征:包括 SDS-PAGE、Western blot、质谱分析、糖型分析、活性测定、内otoxin 检测、内含物分析等。
四、哺乳动物细胞表达优化策略
1. 启动子与调控元件优化
不同启动子(CMV、EF-1α、CAG、SV40 等)在不同细胞系中的表达活性不同,通过筛选适合体系的启动子组合可提升表达。
在启动子上下游加入增强子、隔离子、5’ UTR 优化、microRNA 结合位点调控等元件,可帮助提高转录稳定性与翻译效率。
正如前面提到的,在目标基因上游加入 Kozak 序列或 Leader 序列可提升翻译起始效率,从而提高蛋白产量。
2. 细胞工程改造
基因敲除 / 抑制凋亡基因:研究中已有通过敲除 Apaf1 等凋亡相关基因,使细胞在表达阶段存活率更高,从而提升最终产率。
代谢调控 / 细胞生命周期控制:控制细胞增殖与营养代谢通量,以减轻代谢负担、延长高表达阶段、降低细胞应激。
宿主细胞基因组优化:通过基因组定点编辑(CRISPR/Cas9 等)调控宿主基因(如翻译机制、蛋白折叠、糖基化相关酶、应激响应通路等),以优化表达效率与翻译后修饰性能。
稳定质粒维持机制 / 异源复制系统:如 QMCF 技术可在细胞中维持质粒不整合复制,从而提供一种介于瞬时与稳定表达之间的高效系统。
3. 过程工程优化
温度调控:在表达阶段略微降低温度(如 32–34°C),可减缓细胞代谢、减轻应激,促进蛋白正确折叠,常见于工业表达策略。
营养配方优化:针对不同阶段(增殖期 vs 表达期)设计不同营养配方,如限制某些代谢底物、添加补充剂(如生长因子、氨基酸、抗氧化剂等)以降低代谢压力与氧化应激。
控氧 / 气体传输 / 剪切控制:在大规模生物反应器中,氧气供给、搅拌/混合效率与剪切力控制是关键参数,对细胞存活与表达影响大。优化这些工程参数是提高产量和稳定性的关键。
4. 多基因共表达 / 伴侣蛋白辅助
对于多亚基复合物蛋白或需要折叠辅助(如伴侣蛋白、酶促辅助因子等)的蛋白,可通过共表达这些辅助蛋白以提高组装效率或活性。
在设计载体时,可使用 IRES、2A 肽或多表达盒设计,实现多个基因在同一载体或多个载体中平衡表达。
5. 高通量筛选与基因表达调控工具
利用高通量筛选技术(如荧光筛选、流式细胞术、荧光报告基因、microfluidics 等)快速鉴定高产克隆。
近年来兴起的转录后调控工具(如 siRNA、miRNA、CRISPRa/i、RNA 结构调控元件等)也可用于在哺乳动物细胞中精细调节目标基因的表达强度。