

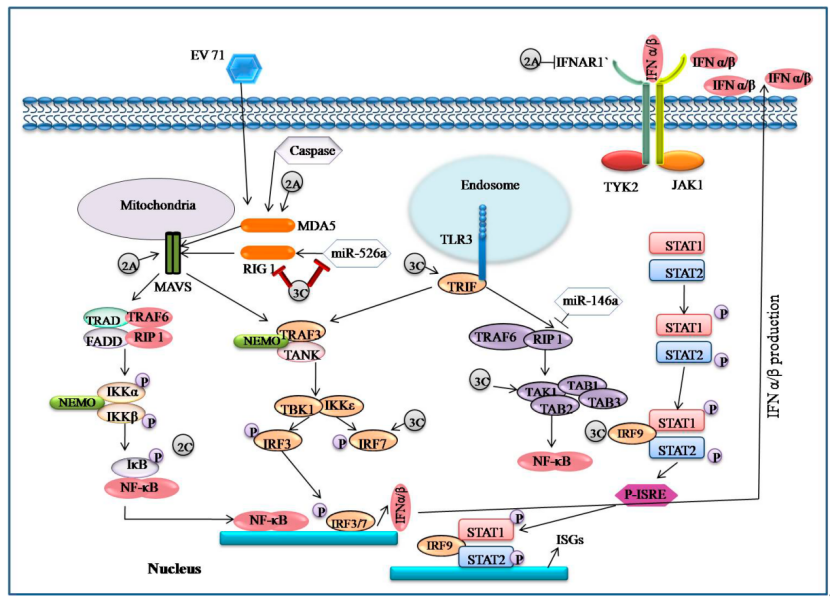
肠道病毒71型(EV71)是小核糖核酸病毒科的重要成员,其病毒颗粒呈现直径约30纳米的二十面体对称结构,由VP1、VP2、VP3和VP4四种衣壳蛋白精确组装而成,形成稳定的保护外壳。颗粒表面呈峡谷状构象,这种独特的空间结构在病毒与宿主受体的相互作用中起到关键作用。病毒基因组编码的多聚蛋白经过特异性蛋白酶加工,最终产生成熟蛋白质组分,为基础研究提供了明确的分子靶点。
▌结构蛋白的三维构象与功能特征
VP1蛋白构成衣壳的主要外露部分,其表面分布有多个保守抗原决定簇。三维结构解析显示,VP1的β-桶状核心周围环绕BC、DE环等环状区域,其中包含关键构象型中和表位。这些环在受体结合时发生局部构象变化,暴露出疏水区域,为分子互作研究提供精确模型。结构分析表明,第215位谷氨酸残基对于维持蛋白折叠和抗原结构稳定性至关重要。
VP2和VP3蛋白与VP1共同形成连续的蛋白外壳,通过氢键和疏水相互作用形成稳定三聚体单元。冷冻电镜显示,VP2的EF环深入相邻原体峡谷底部以稳定局部结构;VP3的N端延伸至峡谷边缘,参与受体结合界面形成。VP4则定位于病毒内部,其N端的肉豆蔻酰化修饰在颗粒组装稳定性方面发挥重要作用。
▌蛋白酶的结构与功能
EV71病毒多聚蛋白的精确加工依赖2A和3C蛋白酶。2A蛋白酶属于半胱氨酸蛋白酶家族,其催化中心由Cys109、His20和Asp38组成典型三联体,能够在P1甘氨酸与P1’脯氨酸之间进行特异性切割。其β-桶折叠结构及相对宽松的底物结合口袋为多底物识别提供了分子基础。
3C蛋白酶具有胰蛋白酶样折叠,活性中心由Cys147、His40和Glu71组成,底物识别需要至少六个氨基酸残基协同参与。晶体结构显示,其底物结合通道呈特定电荷分布,S1口袋偏好谷氨酰胺残基,S4口袋则偏好疏水性氨基酸。这种精细识别确保了多聚蛋白加工的顺序性和效率。
▌重组蛋白在分子互作研究中的应用
利用表面等离子体共振(SPR)技术,研究者通过重组VP1蛋白系统测定其与SCARB2受体的结合动力学,结果显示结合常数为纳摩尔级别,符合典型1:1结合模型。突变分析进一步确认VP1峡谷底部保守残基在受体识别中具有决定性作用。这类实验为病毒入侵机制提供了定量参考。
蛋白酶活性研究中,基于荧光共振能量转移(FRET)建立的检测体系可精确测定2A与3C蛋白酶的动力学参数。例如,3C蛋白酶在切割3AB/3CD连接处显示最高催化效率,达到每秒15次以上,为酶学研究提供了定量基础。
▌蛋白质工程在基础研究中的应用
结构导向蛋白质工程允许对VP1蛋白的抗原表位进行系统改造,优化柔性环、引入特定位点糖基化及二硫键稳定关键环状结构。这些工程化蛋白在免疫学研究中展示了更高效的表位呈现能力,为基础病毒学研究提供可重复实验模型。
在病毒样颗粒(VLP)构建中,通过控制VP0、VP1和VP3的表达比例及组装条件,可获得结构均一、稳定性良好的颗粒。冷冻电镜分析确认这些颗粒在表面拓扑和抗原表位呈现方面与天然病毒高度一致,为病毒组装机制解析提供可靠实验材料。
整合结构生物学方法能够深入解析蛋白复合物的组装与功能。X射线晶体学提供原子分辨率信息,冷冻电镜呈现整体结构,氢氘交换质谱技术可研究蛋白在溶液中的构象动态。这些多维度技术结合,为基础分子互作和蛋白动力学研究提供了强大工具。
在高通量筛选平台中,重组蛋白可用于酶活性检测与细胞表型分析结合,实现化合物库快速筛选。进一步的结构解析可揭示抑制剂与靶蛋白相互作用,为基础研究提供精准分子数据支持。