

融合蛋白重组表达技术是指通过基因工程技术,将编码目标蛋白的序列与一段编码特定功能肽或蛋白质的序列(即“标签”或“融合伴侣”)连接,构建成单一开放阅读框,从而在宿主系统中表达为一条融合多肽链。该技术不仅提升了重组蛋白的产量与可溶性,还通过标签赋予蛋白特定的生化特性,极大简化了下游纯化与检测流程。
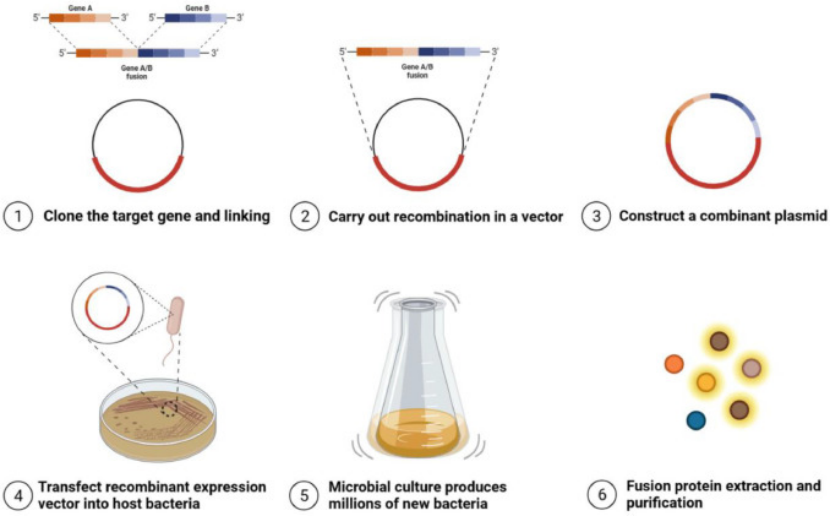
▌融合蛋白的设计策略
融合蛋白的设计需综合考虑研究目的、宿主系统及下游应用。通常,融合标签可分为两类:一类以简化纯化为主要目的,如多聚组氨酸标签(His-tag)、谷胱甘肽S-转移酶(GST)标签、麦芽糖结合蛋白(MBP)标签等;另一类则用于增强蛋白可溶性、促进正确折叠或实现特定功能,如硫氧还蛋白(Trx)、SUMO标签及荧光蛋白标签(如GFP)。标签可置于目标蛋白的N端或C端,选择时需注意其是否影响目标蛋白的天然构象或活性。
▌常用标签系统及其特性
多聚组氨酸标签(His-tag):由6-10个组氨酸残基组成,可与镍、钴等金属离子螯合,用于固定金属亲和层析(IMAC)。His-tag分子量小、免疫原性低,通常不影响蛋白折叠,且耐受多种变性条件,适用于变性条件下的纯化。
⦁ GST标签:大小为26 kDa,来源于血吸虫谷胱甘肽S-转移酶。该标签可增强部分蛋白的可溶性,并通过与谷胱甘肽琼脂糖珠亲和层析实现高效纯化。GST标签还可用于蛋白-蛋白互作研究。
⦁ MBP标签:约40 kDa,来源于大肠杆菌的麦芽糖结合蛋白。作为分子伴侣,MBP能显著提高融合蛋白在大肠杆菌中的可溶性,并通过直链淀粉树脂纯化。
⦁ SUMO标签:小类泛素样修饰蛋白,不仅可增强可溶性,还能被SUMO蛋白酶特异性识别并切割,切除后可在目标蛋白N端留下天然氨基酸序列。
⦁ 荧光蛋白标签:如GFP、mCherry等,用于实时监测蛋白表达定位,无需额外染色。
▌表达宿主的选择
融合蛋白的表达宿主需根据蛋白特性、修饰需求及规模确定。大肠杆菌系统成本低、操作简便,适用于无需复杂翻译后修饰的蛋白;哺乳动物细胞(如HEK293、CHO)可完成糖基化、磷酸化等修饰,更适用于功能研究;昆虫杆状病毒系统则介于两者之间,适合表达较大分子量蛋白。标签的选择也受宿主影响,如His-tag在各系统中通用,而GST标签在原核系统中效果更佳。
▌纯化与标签切除
融合蛋白纯化主要利用标签与配基的特异性结合。例如,His-tag采用IMAC层析,GST标签使用谷胱甘肽柱,MBP标签则通过直链淀粉树脂捕获。纯化后,若需去除标签以获得天然结构蛋白,可在融合序列中引入蛋白酶识别位点(如TEV、凝血酶、Factor Xa等)。切割条件需优化以避免非特异性降解。对于无需切除的标签,需评估其对蛋白功能的影响。
▌应用注意事项
在科研试剂制备中,融合蛋白的设计需平衡纯化效率与蛋白活性。标签可能影响蛋白构象或互作,建议通过对比实验验证功能。此外,不同宿主中密码子偏好性、折叠环境差异可能影响表达效率,可借助生物信息学工具优化序列。纯化过程中,缓冲液成分、pH及离子强度也需根据蛋白特性调整,以维持稳定性。
▌结语
融合蛋白重组表达技术为科研用重组蛋白的制备提供了灵活高效的解决方案。通过合理选择标签与表达系统,可显著提升蛋白产量与质量,支持包括结构生物学、互作组学在内的多种基础研究。
参考文献
1.Kimple, M. E., Brill, A. L., & Pasker, R. L. Overview of affinity tags for protein purification. Current Protocols in Protein Science 73, 9.9.1-9.9.23 (2013).
2.Young, C. L., Britton, Z. T. & Robinson, A. S. Recombinant protein expression and purification: a comprehensive review of affinity tags and microbial applications. Biotechnology Journal 7, 620-634 (2012).
3.Esposito, D. & Chatterjee, D. K. Enhancement of soluble protein expression through the use of fusion tags. Current Opinion in Biotechnology 17, 353-358 (2006).